ДИСТАНЦИОННОЕ ОБУЧЕНИЕ
27 апреля 2020
18 мая 2020
Тема урока: НЕМЕТАЛЛЫ
Это п. 21 учебника.
Уважаемые одиннадцатиклассники!
Внимательно слушайте уроки и отвечайте на вопросы!!!
Открывайте ссылку:
https://drive.google.com/file/d/1WXXoE_Adt0utmxptigYCBMr43n45iaFV/view?usp=sharing
Миша, Вова, Давид, Александр, Саша, Сергей, Ростик, Влад, Света, Даня!!! Жду ваши работы до 17 мая!
Для ЕГЭ по неметаллам:
20 апреля 2020
Тема урока: МЕТАЛЛЫ
Это п. 20 учебника.
https://drive.google.com/file/d/1R2ubhmYj5Ae04bIhd5iTRcA6p0pIVX-u/view?usp=sharing
Жду ваши ответы до 27 апреля на эл.почту: svetlvik@yandex.ru
ПЛОДОТВОРНОЙ РАБОТЫ!!!!!
13 апреля 2020
Тема урока: Газообразные вещества
Уважаемые одиннадцатиклассники!
Сегодня закончен прием работ по Дисперсным системам.
Выкладываю для изучения новый материал по теме "Газообразные вещества".
Посмотрите видеоурок. (По учебнику это п.8).
Ответьте письменно на вопросы. Ответы вышлите до 18 апреля по адресу: svetlvik@yandex.ru
УСПЕШНОГО ИЗУЧЕНИЯ!!!!!
ПРОВЕРОЧНАЯ ЧАСТЬ УРОКА (сумма баллов за работу-25):
О каком газе идет речь?
1. С этим газом связан парниковый эффект.
2. Это самый легкий газ.
3. Он поддерживает дыхание и горение.
4. С этими газами связаны кислотные дожди.
5. Этого газа в воздухе 78%
6. Это газ зелёного цвета
7. Его применяют для приготовления шипучих напитков
8. Он выделяется при разложении перекиси водорода
9. Из этого газа получают материал для обложек тетрадей
10. Он входит в состав нашатырного спирта
11. Это основной газ в составе природного газа
12. Его в замороженном состоянии называют "сухой лёд"
13. Смесь каких газов называют ГРЕМУЧИМ ГАЗОМ?
14. Какой обьем занимает 1 моль любого газа при н.у.?
15. Это газ голубого цвета, задерживающий УФ-лучи.
16. Напишите реакции для получения в лаборатории:
-водорода
-кислорода
-углекислого газа
-аммиака.
Укажите признаки для их распознавания.
17. Какие из газов в задании 16 можно собирать в перевернутую вверх дном пробирку? Почему?
6 апреля 2020
Тема урока: Дисперсные системы
Уважаемые одиннадцатиклассники!
Изучите материал. Ответьте письменно на вопросы. Ответы вышлите до 12 апреля по адресу: svetlvik@yandex.ru
1. Какие системы называются дисперсными?
2. Перепишите классификацию ДС в тетрадь.
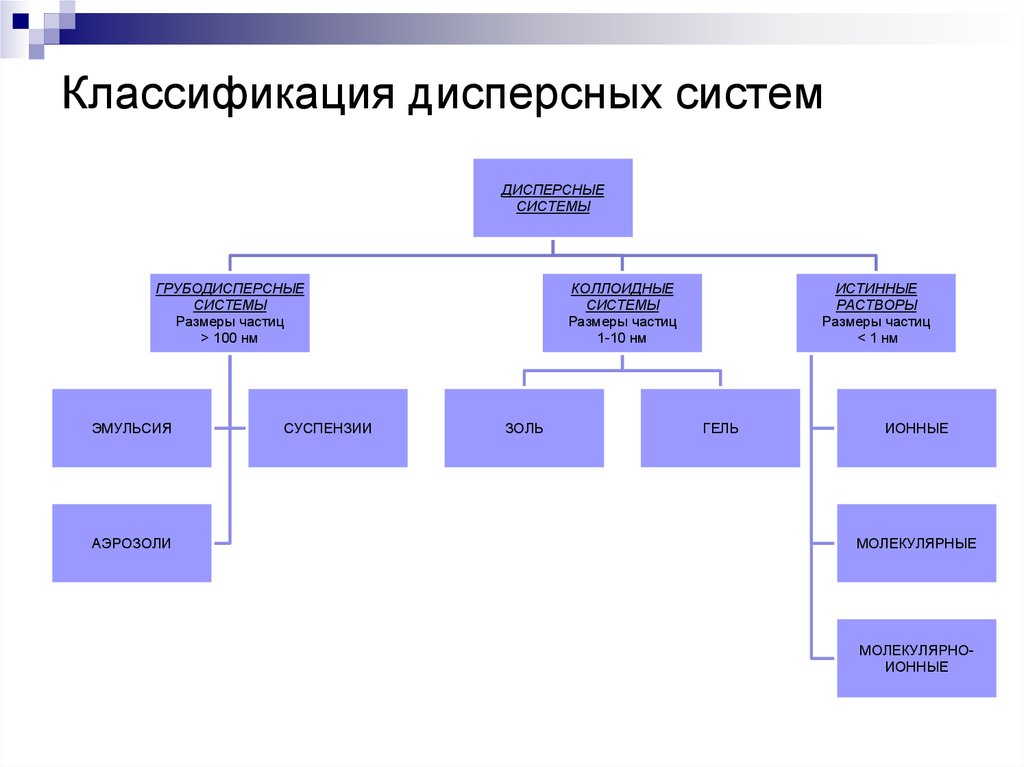
3. В схему впишите определения и примеры каждой ДС.
4. Что называют дисперсной фазой и дисперсной средой?
5. Перерисуйте таблицу. Приведите примеры дисперсных систем.
Дисперсионная среда
|
Дисперсионная фаза
| ||
газ
|
жидкость
|
Твердое вещество
| |
Газ
| |||
Жидкость
| |||
Твердое вещество
| |||
6. Для того, чтобы отличить истинный раствор от коллоидного, используют эффект Тиндаля? В чем суть этого эффекта?
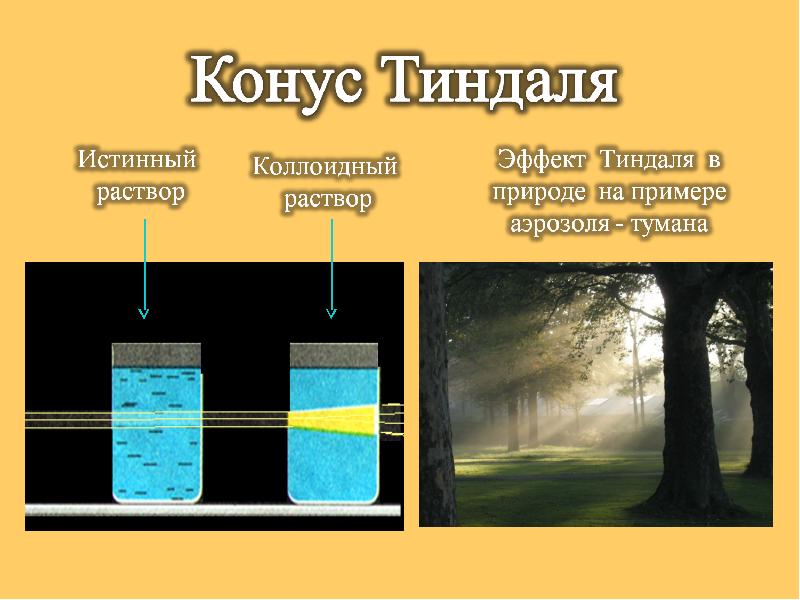
УСПЕШНОГО ИЗУЧЕНИЯ!!!!!!
Тесты для отработки тем "Химическая связь" и "Кристаллические решетки" (сделать к 15.10.2018)
https://drive.google.com/open?id=1rW1gozkyeYcwLlt1Gdo-fyofdPSqPVUV
На сайте Гущина "Решу ЕГЭ" есть задания для подготовки к ЕГЭ. Решайте задания формата 2018 года!!!!!
https://chem-ege.sdamgia.ru/test?a=catlistwstat
Для подготовки к ЕГЭ
Сайты:
HimEge.ru
1. On-line тестирование по химии: Пройдите On-line тестирование по химии и узнайте свой уровень подготовки. http://licei1kh.ucoz.ru/publ/10
2. WebElements: онлайн-справочник химических элементов: Щелкнув по любому элементу вы получите полную информацию о нем. http://webelements.narod.ru/
3. Библиотека книг для ЕГЭ по химии: Книги для подготовки к ЕГЭ химия. http://www.ctege.org/razdel.php?s=&razdelid=239
4. Книги для подготовки к ЕГЭ по химии. Демоверсии ЕГЭ 2004-2009 год: Типовые задания к егэ по химии включают все типы заданий встречающихся на егэ. Программа с огромной базой тестов по химии. Материалы в программе были взяты из демоверсий по химии, а также из реальных вариантов ЕГЭ предыдущих годов. http://4ege.ru/himiya/
5. Коллекция шпаргалок по химии за 9-11 класс: Шпаргалки по химии за 9-11 класс. http://v-a-m-pir-1989.narod.ru/shpora2.html
6. Основы химии. Электронный учебник.: Наш базовый уровень ориентирован на успешную сдачу теоретических разделов ЕГЭ, а профильный уровень соответствует программе по химии для поступающих в Новосибирский государственный университет, которая несколько шире стандартных профильных программ. Профильный уровень следует читать вместе с 1-м уровнем. Читателям, желающим освоить только более легкий базовый уровень, можно пропускать разделы 2-го уровня (они помечены звездочками (**) и напечатаны темно-синим шрифтом). При этом целостность восприятия материала не нарушается. http://www.hemi.nsu.ru/
7. Подготовка к ЕГЭ по химии 2010. Теория. Задания. Ответы: На данном сайте вы найдете теоретический материал по химии, а так же тесты и ответы к ним. http://maratakm.narod.ru/index.files/09.htm
8. Сайт о химии. Химическая энциклопедия. Учебники.: Здесь вы найдете: химическую энциклопедию, учебники, таблицу Менделеева и многое другое. http://www.xumuk.ru/
9.. Учебники по химии в электронном формате: Здесь вы найдете курс по органической и неорганической химии и шпаргалки в таблицах. http://www.xenoid.ru/materials/himiya/default.php
10. Учебные пособия по химии. Решение задач по химии. : Все основные учебные пособия по химии размещены здесь. Решение задач по химии. Примеры решений задач по химии выпускных экзаменов, вступительных экзаменов, олимпиад, контрольных и т.д. http://chem-solution.narod.ru/example_offline_books.html
Тривиальные названия некоторых неорганических веществ
Тривиальные названия некоторых органических веществ
В приведенном списке первое название – тривиальное, после химической формулы указывается систематическое название вещества.
В приведенном списке первое название – тривиальное, после химической формулы указывается систематическое название вещества.
1.
Альдегид
муравьиный, формальдегид НСНО – метаналь. Раствор формальдегида в воде
называется формалином.
2.
Альдегид
уксусный, ацетальдегид СН3-СНО
– этаналь
3.
Аминокислоты
1. Аланин CH2–CH(NН2)–COOH – α-аминопропионовая кислота
2. Глицин H2N–CH2–COOH – аминоуксусная кислота
3. Глутаминовая кислота НООС–СН2–СН2–СН(NН2)–COOH – α-аминоглутаровая кислота
4. Лизин NH2–CH2–CH2–CH2–CH2–CH(NН2)–COOH – α,ε-диаминокапроновая кислота
5. Серин ОН–СН2–СН(NН2)–COOH – α-амино-β-оксипропионовая кислота
6. Тирозин ОН-С6Н4–СН2–СН(NН2)–COOH – β-(пара-оксифенил)-α-аминопропионовая кислота
7. Фенилаланин С6Н5–СН2–СН(NН2)–COOH – α-амино-β-фенилпропионовая кислота
8. Цистеин HS-СН2–СН(NН2)–COOH – α-амино-β-тиопропионовая кислота
Примечание: из аминокислот необходимо знать систематические названия только аминоуксусной и аминопропионовой кислот, для остальных – только тривиальные.
1. Аланин CH2–CH(NН2)–COOH – α-аминопропионовая кислота
2. Глицин H2N–CH2–COOH – аминоуксусная кислота
3. Глутаминовая кислота НООС–СН2–СН2–СН(NН2)–COOH – α-аминоглутаровая кислота
4. Лизин NH2–CH2–CH2–CH2–CH2–CH(NН2)–COOH – α,ε-диаминокапроновая кислота
5. Серин ОН–СН2–СН(NН2)–COOH – α-амино-β-оксипропионовая кислота
6. Тирозин ОН-С6Н4–СН2–СН(NН2)–COOH – β-(пара-оксифенил)-α-аминопропионовая кислота
7. Фенилаланин С6Н5–СН2–СН(NН2)–COOH – α-амино-β-фенилпропионовая кислота
8. Цистеин HS-СН2–СН(NН2)–COOH – α-амино-β-тиопропионовая кислота
Примечание: из аминокислот необходимо знать систематические названия только аминоуксусной и аминопропионовой кислот, для остальных – только тривиальные.
4.
Анилин
С6Н5-NН2 – фениламин
5.
Ацетилен
СН≡СН – этин
6.
Ацетон
СН3-С(О)-СН3 – пропанон
7.
Винилацетилен
СН≡С–СН=СН2 – 1-бутен-3-ин
8.
Винный
спирт С2Н5ОН – этанол
9.
Виноградный
сахар С6Н12О6 – глюкоза
10. Гидрохинон НО-С6Н4-ОН – 1,4-дигидроксибензол
11. Глицерин HO–CH2-СН(ОН)-CH2–OH – пропантриол-1,2,3
12. Глицериды – сложные эфиры
глицерина и органических или минеральных кислот. Триглицериды карбоновых кислот
(С4-С18) – входят в состав растительных и
животных жиров.
13. Дивинил СН2=СН-СН=СН2 – бутадиен-1,3
14. Древесный спирт СН3ОН – метанол
15. Изопрен СН2=С(СН3)-СН=СН2 – 2-метилбутадиен-1,3
16. Кислоты карбоновые предельные
1. Муравьиная кислота НСООН – метановая кислота
2. Уксусная кислота СН3СООН – этановая кислота
3. Пропионовая кислота СН3СН2СООН – пропановая кислота
4. Масляная кислота СН3СН2СН2СООН – бутановая кислота
5. Валериановая кислота СН3СН2СН2СН2СООН – пентановая кислота
6. Капроновая кислота СН3СН2СН2СН2СН2СООН – гексановая кислота
7. Пальмитиновая кислота С15Н31СООН, CH3(CH2)14COOH
8. Стеариновая кислота С17Н35СООН, CH3(CH2)16COOH
1. Муравьиная кислота НСООН – метановая кислота
2. Уксусная кислота СН3СООН – этановая кислота
3. Пропионовая кислота СН3СН2СООН – пропановая кислота
4. Масляная кислота СН3СН2СН2СООН – бутановая кислота
5. Валериановая кислота СН3СН2СН2СН2СООН – пентановая кислота
6. Капроновая кислота СН3СН2СН2СН2СН2СООН – гексановая кислота
7. Пальмитиновая кислота С15Н31СООН, CH3(CH2)14COOH
8. Стеариновая кислота С17Н35СООН, CH3(CH2)16COOH
17. Кислоты карбоновые непредельные
1. Акриловая кислота CH2=CH–COOH – пропеновая кислота
2. Метакриловая кислота СН2=С(СН3)-СООН – 2-метилпропеновая кислота
3. Кислота олеиновая СН3(СН2)7СН=СН(СН2)7СООН, С17Н33СООН (одна двойная С-С связь)
4. Кислота линолевая CH3(CH2)3CH2CH=CH-CH2CH=CH-(CH2)7COOH, С17Н31СООН, (две двойные С-С связи)
5. Кислота линоленовая (три двойные С-С связи) С17Н29СООН,
CH3-CH2CH=CH-CH2CH=CH-CH2CH=CH-(CH2)7COOH
1. Акриловая кислота CH2=CH–COOH – пропеновая кислота
2. Метакриловая кислота СН2=С(СН3)-СООН – 2-метилпропеновая кислота
3. Кислота олеиновая СН3(СН2)7СН=СН(СН2)7СООН, С17Н33СООН (одна двойная С-С связь)
4. Кислота линолевая CH3(CH2)3CH2CH=CH-CH2CH=CH-(CH2)7COOH, С17Н31СООН, (две двойные С-С связи)
5. Кислота линоленовая (три двойные С-С связи) С17Н29СООН,
CH3-CH2CH=CH-CH2CH=CH-CH2CH=CH-(CH2)7COOH
18. Кислоты другие
1. Щавелевая кислота НООС-СООН – этандиовая кислота
2. Молочная кислота CH3-CH(OH)-COOH – 2-гидроксипропановая кислота
3. Фталевая (о-фталевая) кислота НООС-C6H4-COOH – 1,2-бензолдикарбоновая кислота
4. Изофталевая (м-фталевая) кислота НООС-C6H4-COOH – 1,3-бензолдикарбоновая кислота
5. Терефталевая (п-фталевая) кислота НООС-C6H4-COOH – 1,4-бензолдикарбоновая кислота
1. Щавелевая кислота НООС-СООН – этандиовая кислота
2. Молочная кислота CH3-CH(OH)-COOH – 2-гидроксипропановая кислота
3. Фталевая (о-фталевая) кислота НООС-C6H4-COOH – 1,2-бензолдикарбоновая кислота
4. Изофталевая (м-фталевая) кислота НООС-C6H4-COOH – 1,3-бензолдикарбоновая кислота
5. Терефталевая (п-фталевая) кислота НООС-C6H4-COOH – 1,4-бензолдикарбоновая кислота
19. Ксилол СН3-С6Н4-СН3 – диметилбензол (существует 3
изомера: 1,2/1,3/1,4-диметилбензолы)
20. Крезол СН3-С6Н4-ОН – гидроксиметилбензол (существует
3 изомера: 1,2/1,3/1,4)
21. Кумол С6Н5-СН(СН3)2 – изопропилбензол
22. Парафины CnH2n+2 – алканы
23. Пикриновая кислота НО-С6Н2-(NО2)3 – 2,4,6-тринитрофенол
24. Плодовый сахар С6Н12О6 – фруктоза
25. Пирокахетин НО-С6Н4-ОН – 1,2-дигидроксибензол
26. Резорцин НО-С6Н4-ОН – 1,3-дигидроксибензол
27. Стирол C6H5-CH=CH2 – винилбензол
28. Толуол С6Н5-СН3 – метилбензол
29. Фенол (карболовая кислота) С6Н5-ОН – гидроксибензол
30. Циклопарафины CnH2n – циклоалканы
31. Хлоропрен СН2=ССlСН=СН2 – 2-хлор-1,3-бутадиен
32. Хлороформ СНСl3 – трихлорметан
33. Этиленгликоль HO–CH2-CH2–OH – этандиол-1,2
Именные реакции в органической химии
7. Реакция Фриделя-Крафтса: алкилирование и ацилирование аренов и их производных в присутствии безводного AlCl₃. Классический пример — алкилирование бензола алкилгалогенидами (HCl, HBr, HI).
Общий вид реакции: C₆H₆+ R-Hal =[AlCl₃]=> C₆H₅-R + HHal
Реакция на примере хлора:
C₆H₆+ CH₃Cl =[AlCl₃]=> C6H5-CH₃ + HCl
Именные реакции в органической химии
Получение
1. Реакция Вюрца: действие металлического натрия на моногалогенопроизводные углеводородов. Происходит удвоение углеродного скелета. Реакция подходит для получения симметричных алканов.
2CH3–CH2Br + 2Na = CH3–CH2–CH2–CH3 +2NaBr
1. Реакция Вюрца: действие металлического натрия на моногалогенопроизводные углеводородов. Происходит удвоение углеродного скелета. Реакция подходит для получения симметричных алканов.
2CH3–CH2Br + 2Na = CH3–CH2–CH2–CH3 +2NaBr
2. Реакция Дюма:
декарбоксилирование солей карбоновых кислот — сплавление со щелочами.
CH3COONa (тв.) + NaOH(тв.) = CH4 + Na2CO3
CH3COONa (тв.) + NaOH(тв.) = CH4 + Na2CO3
3. Реакция Кольбе:
электролиз растворов солей карбоновых кислот:
CH3COONa + 2H2O =[эл.ток]=> 2СО2 + Н2 + С2Н6 + 2NaOH
CH3COONa + 2H2O =[эл.ток]=> 2СО2 + Н2 + С2Н6 + 2NaOH
4. Синтез Густавсона:
отщепление двух атомов галогена от дигалогеналканов:
СlCH2-CH2-CH2-CH2Cl + Zn = C4H8 (циклобутан) + ZnCl2
Вместо магния может использоваться цинк.
СlCH2-CH2-CH2-CH2Cl + Zn = C4H8 (циклобутан) + ZnCl2
Вместо магния может использоваться цинк.
5. Синтез Лебедева:
получение бутадиена из этанола.
2C2H5OH = Н2 + 2Н2O + CH2=CH-CH=CH2
2C2H5OH = Н2 + 2Н2O + CH2=CH-CH=CH2
Химические свойства
1. Реакция Коновалова – нитрование алканов разбавленной (10%-ной) азотной кислотой:
C2H6 + HNO3 = C2H5NO2 + Н2O
Избирательность нитрования:
третичный атом > вторичный атом > первичный атом углерода.
1. Реакция Коновалова – нитрование алканов разбавленной (10%-ной) азотной кислотой:
C2H6 + HNO3 = C2H5NO2 + Н2O
Избирательность нитрования:
третичный атом > вторичный атом > первичный атом углерода.
2. Эффект Хараша: присоединение
бромоводорода в присутствии перекиси. Реакция протекает против правила
Марковникова:
СН3-СН=СН2 + HBr =[Н2О2]=> СН3-СН2-СН2Br
СН3-СН=СН2 + HBr =[Н2О2]=> СН3-СН2-СН2Br
3. Реакция Вагнера:
реакция с холодным водным раствором перманганата калия – мягкое окисление
алкенов (образуется диол)
3СН3-СН=СН2 + 2KMnO4 + 4H2O = 2MnO2 + 2KOH + 3СН3 -СН(OH)-СН2(OH)
3СН3-СН=СН2 + 2KMnO4 + 4H2O = 2MnO2 + 2KOH + 3СН3 -СН(OH)-СН2(OH)
4. Реакция Кучерова:
гидратация алкинов. Присоединение воды происходит в присутствии солей
ртути (II) и идет через образование неустойчивого енола, который
изомеризуется в альдегид или кетон. Гидратация ацетилена дает альдегид, других
алкинов – кетон.
C2H2 + H2O = CH3CHO
C2H2 + H2O = CH3CHO
5. Реакция Зелинского:
тримеризация ацетилена над активированным углем. Образуется бензол.
3C2H2 = C6H6
3C2H2 = C6H6
6. Реакция Зинина:
восстановление нитросоединений в растворе в щелочной и нейтральной среде:
R-NO2 + 3(NH4)2S = R-NH2 + 3S + 6NH3 +2H2O
R-NO2 + 3(NH4)2S = R-NH2 + 3S + 6NH3 +2H2O
7. Реакция Фриделя-Крафтса: алкилирование и ацилирование аренов и их производных в присутствии безводного AlCl₃. Классический пример — алкилирование бензола алкилгалогенидами (HCl, HBr, HI).
Общий вид реакции: C₆H₆+ R-Hal =[AlCl₃]=> C₆H₅-R + HHal
Реакция на примере хлора:
C₆H₆+ CH₃Cl =[AlCl₃]=> C6H5-CH₃ + HCl
Кислоты и их соли





Комментариев нет:
Отправить комментарий